Piede torto nei neonati. Semplici regole per non sbagliare.
Esistono diverse tipologie di “piede torto“: piede torto posizionale, metatarso varo, piede equino-varo-supinato (piede torto classico), piede reflesso e piede talo-valgo-pronato. Ognuna di queste forme presenta caratteristiche peculiari, ed ogni tipologia di “piede torto” necessita di un differente trattamento.
Saper distinguere un piede torto classico da una delle altre forme è essenziale.
Ecco qui una scheda semplice, pensata per pediatri, studenti e chiunque si stia avvicinando all’ortopedia pediatrica!! Ideata dai medici di OrtoPediatria, che da anni si occupano di piede torto congenito e pubblicano lavori sull’argomento: Manuele Lampasi (uno dei pochi medici italiani certificati dalla Ponseti International Association), Camilla Bettuzzi e Giada Salvatori (formatesi rispettivamente a NY presso il centro Ponseti guidato dal Prof.Lehman e ad Iowa City con il Prof. Morcuende erede di Ignacio Ponseti).
Clicca qui per aprire la scheda I VARI TIPI DI PTC

Gestione a domicilio del gesso Ponseti
Le istruzioni per la gestione dei gessi
Istruire correttamente i genitori per una buona gestione del gesso Ponseti è fondamentale per un sereno rientro a casa, dopo che al piccolo paziente è stato confezionato un gesso correttivo per il piede torto congenito.
In questo ultimo video, ai genitori vengono indicati gli errori da evitare, e mostrate le accortezze ed i suggerimenti per la migliore gestione del vostro bambino in cura presso la Ponseti Clinic per una problematica di piede torto congenito.
Per sapere di più sul piede torto congenito e sul metodo Ponseti vai alla scheda dedicata
Come già mostrato nel video precedente, i gessi vengono applicati in regime ambulatoriale. Durante la procedura il bambino viene assistito dai genitori. A fine procedura i nostri medici mostrano ai genitori tutte le accortezze necessarie per la corretta gestione del gesso Ponseti, ed evitare di incorrere in spiacevoli ed evitabili complicazioni.
Come mostrato nel video, è fondamentale mantenere l’arto elevato, al fine di favorire il corretto ritorno venoso, e prevenire la comparsa di edema e tumefazione. Le dita vanno periodicamente controllate, per verificare che la circolazione sia regolare e non siano presenti deficit di motilità. Va inoltre controllato che il gesso sia correttamente posizionato, e che il piede non si sfili all’interno del gesso.
In caso di riscontro di problematiche o in presenza di dubbi, è consigliabile rivolgersi al medico che ha in cura il piccolo paziente.
Sul nostro sito è presente anche una scheda di consigli pratici per i genitori, consultabile e scaricabile liberamente.
Per qualsiasi informazione non esitare a contattarci alla email info@ortopediatria.org
Visita il nostro Ponseti Center

Come vengono confezionati i gessi secondo il metodo Ponseti
La nostra Ponseti Clinic e il confezionamento dei gessi
Presso la nostra Ponseti Clinic vengono settimanalmente confezionati gessi correttivi per il piede torto congenito, secondo il metodo Ponseti. Nel nostro centro operano medici certificati dalla Ponseti International Association, che seguono protocolli standardizzati e riconosciuti a livello internazionale.
Un nuovo video, utile per genitori che si trovano ad affrontare per la prima volta questa inattesa situazione e per professionisti sanitari che non conoscono ancora bene la metodica, mostra come avviene la procedura presso il nostro centro specialistico.
La procedura, che si inserisce all’interno di un ciclo correttivo di gessi Ponseti, consiste nel confezionamento settimanale di apparecchi gessati, femore-pedidi, modellati direttamente sul paziente. Il piede torto non viene portato in posizioni forzate, ma viene gentilmente accompagnato in graduale correzione, mediante attente e specifiche metodiche manipolative.
Il gesso viene rinnovato settimanalmente, registrando di volta in volta la correzione ottenuta, e portando con gradualità la deformità alla progressiva e completo riallineamento. In circa l’80-90% dei casi, le sole manipolazioni associate a gessi correttivi, non sono sufficienti alla correzione completa del piede torto. In questi casi la procedura con gli apparecchi gessati si associa ad un piccolo intervento di tenotomia percutanea del tendine d’Achille, che viene nel nostro centro effettuato in anestesia locale.
Per sapere di più vai alla scheda dedicata
I gessi vengono effettuati in regime ambulatoriale, durante la procedura il bambino viene assistito dai genitori. Vengono utilizzate musiche e suoni bianchi per favorire il rilassamento. Solitamente viene consigliato alla madre di allattarlo, in modo da tranquillizzare il neonato e aumentare il rilassamento delle strutture.
Per qualsiasi informazione non esitare a contattarci alla email info@ortopediatria.org
Visita il nostro Ponseti Center

OrtoPediatria al corso di aggiornamento sulle deformità congenite del dr. Paley
Si è tenuto dal 15 al 19 gennaio, presso la Paley Foundation, il corso sulle deformità congenite del dr. Paley. OrtoPediatria non poteva mancare! Il dott. Lucchesi si è recato a West Palm Beach (USA) per seguire questa preziosissima formazione, grazie alla quale i nostri pazienti potranno sottoporsi alle cure necessarie in Italia.

Un corso intensivo, volto allo studio delle deformità congenite nei vari aspetti di diagnosi e trattamento, che ha raccolto quasi cento chirurghi provenienti da tutto il mondo.
Una grande occasione per approfondire e trovare sempre nuovi spunti su argomenti quali l’ipoplasia di femore, le emimelie tibiali e peroneali, la pseudartrosi congenita di tibia. I medici di OrtoPediatria già da anni si dedicano al trattamento delle deformità congenite del paziente pediatrico, e la possibilità di protesi confrontare con uno dei più grandi esperti della materia ha rappresentato una occasione preziosa di crescita.

Nel corso della sua permanenza in Florida, il dott. Lucchesi ha potuto assistere a diversi interventi ricostruttivi di SUPERHip, SUPERAnkle, SUPERKnee e CrossUnion, svolti in live surgery dal dott. Paley. Ha inoltre potuto visitare il Paley Institute, per cogliere gli aspetti organizzativi che possono aiutare a migliorare l’attività quotidiana anche in Italia.

Questo importante corso di perfezionamento rappresenta una bella occasione di crescita per tutto il gruppo, per poter garantire sempre le migliori cure possibili per i nostri pazienti.
Per approfondimenti sulle deformità congenite degli arti inferiori visita il nostro centro specialistico

Una nuova sezione dedicata alla traumatologia pediatrica
È stata recentemente inserita una nuova sezione dedicata interamente alla traumatologia pediatrica.
In cosa consiste la traumatologia pediatrica?
La traumatologia pediatrica è la branca dell’ortopedia pediatrica che si occupa del trattamento delle fratture e delle lesioni traumatiche dei bambini e dei soggetti in età evolutiva.
Lo scheletro dei soggetti in accrescimento, infatti, differisce in diversi aspetti da quello dell’adulto. Tale diversità si traduce anche nello svilupparsi di lesioni traumatiche differenti, per tipologia e caratteristiche, da quelle dell’individuo a fine crescita.
Considerata l’importanza e la particolarità dell’argomento, OrtoPediatria ha deciso di dedicare una intera sezione all’approfondimento di questa tematica. Sono state create schede riassuntive, che possono essere utili a ortopedici e traumatologi dell’adulto che si trovino di fronte ad un caso pediatrico, a fisioterapisti e personale sanitario, a studenti di medicina o delle scuole di specializzazione, così come ai genitori che vogliano approfondire una eventuale problematica del figlio.
Le schede contengono indicazioni sull’inquadramento diagnostico iniziale, sulla gestione dell’immobilizzazione e sul trattamento, chirurgico e conservativo.
Cliccando sullo scheletrico interattivo sarà facile navigare e scoprire le diverse schede già caricate. Dai vari distretti anatomici è possibile accedere ai vari sottotipi di fratture e lesioni. Vi è anche una sezione dedicata ad alcuni aspetti generici propri delle fratture dell’età pediatrica.
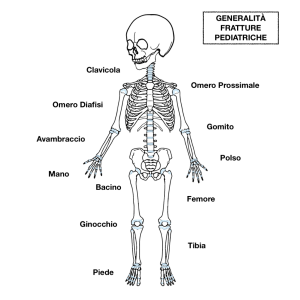
Attualmente sono state caricate le schede relative a gomito, clavicola, polso, femore e tibia … ma altre schede verrano progressivamente caricate. Seguici per rimanere aggiornato!!

Una nuova sede: OrtoPediatria Center
OrtoPediatria Center, l’ortopedia pediatrica in un unico centro
Apre a Bologna una nuova sede per le attività ambulatoriali di ortopedia pediatrica e la piccola chirurgia: OrtoPediatria Center.
OrtoPediatria si allarga ed evolve grazie alla riorganizzazione di diverse attività ambulatoriali e di piccola chirurgia in un’unica, nuova, sede. Questo nuovo progetto ci consente di seguire i pazienti in maniera ancora più completa, dandoci la possibilità di effettuare, in una unica seduta, visite ed esami diagnostici (ecografia delle anche e radiologici), di eseguire trattamenti mediante applicazione di tutori e, se necessario, di gessi.
Le attività all’OrtoPediatria Center
La nostra attività clinica è da sempre indirizzata al trattamento delle più importanti problematiche dell’ortopedia pediatrica, e la nuova organizzazione ambulatoriale è finalizzata ad ottimizzare i percorsi di cura di queste patologie.
- AMBULATORIO DISPLASIA DELLE ANCHE
La diagnostica precoce e trattamento tempestivo della lussazione e della displasia congenita dell’anca rivestono un ruolo fondamentale ai fini della guarigione. Presso il nuovo OrtoPediatria Center abbiamo la possibilità di effettuare ecografie di screening o di secondo livello, esami radiografici, trattamento mediante posizionamento di divaricatori o gessi, oltre alle valutazioni chirurgiche dei casi più complessi.
I pazienti ed i genitori vengono così accompagnati, in tutte le fasi, da una equipe formata e specializzata nella diagnosi e nel trattamento della displasia delle anche.
- CLINICA PONSETI
La tecnica Ponseti è il trattamento di scelta per la cura del piede torto congenito. Grazie alla presenza di medici certificati dalla Ponseti International Association, e da una equipe altamente specializzata nel trattamento del piede torto, i pazienti vengono presi in carico fin dalle prime settimane di vita. Nel nuovo centro medico vengono effettuati i trattamenti con i gessi correttivi, controlli clinici e applicazione dei tutori. Inoltre, abbiamo ora la possibilità di effettuare, sempre nella stessa sede, gli interventi di tenotomia percutanea in anestesia locale, semplificando così la gestione per le famiglie.
- AMBULATORIO CASI COMPLESSI
In questo ambulatorio afferiscono i casi complessi, quali pazienti con problematiche neuro-ortopediche o con gravi deformità congenite/postraumatiche, che necessitano di una valutazione di equipe, con la possibilità di stabilire percorsi terapeutici adeguati e dedicati al singolo caso.
- VISITE ORTOPEDICHE PEDIATRICHE
Ovviamente trovano spazio anche le valutazioni cliniche delle più comuni problematiche dell’ortopedia pediatrica, quali:
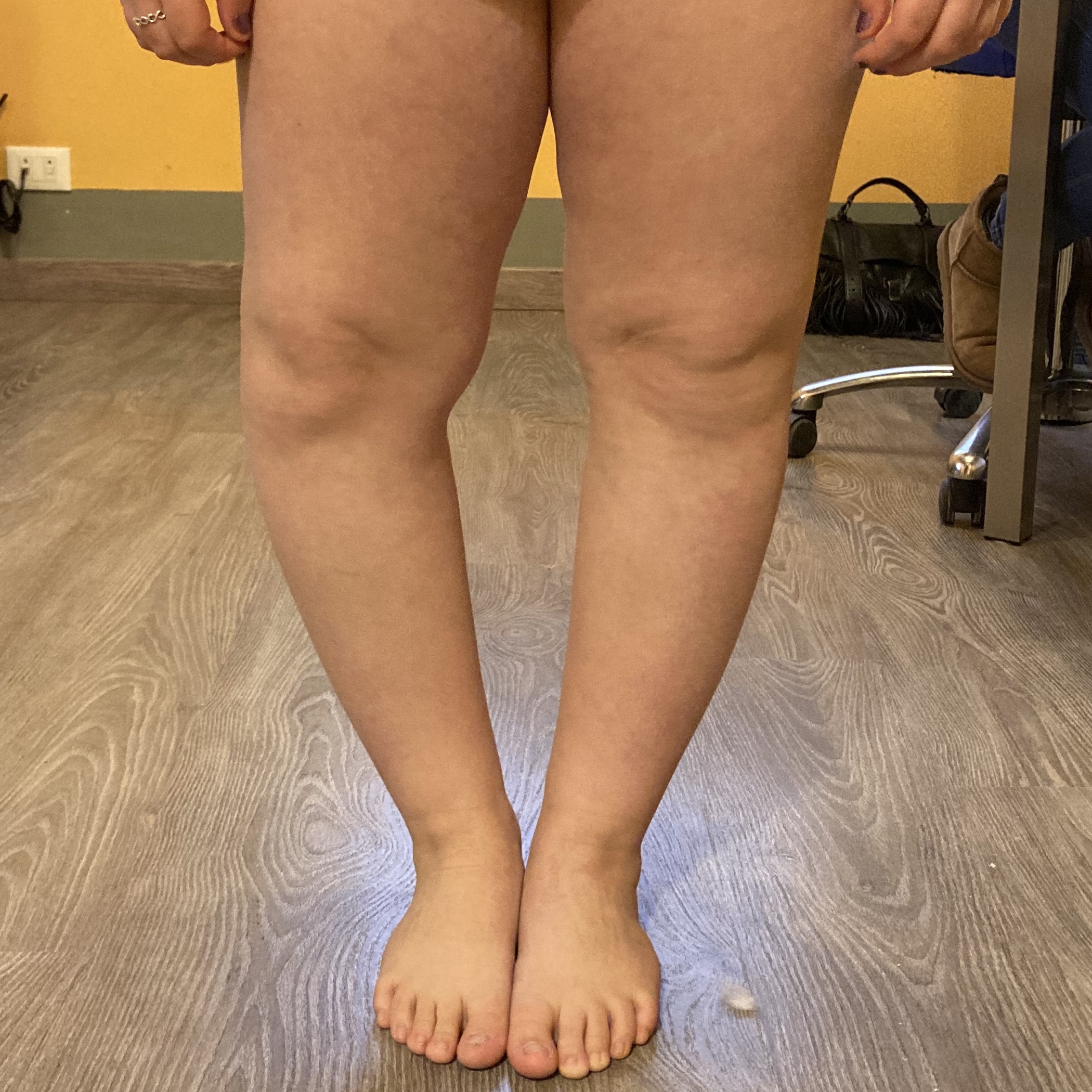
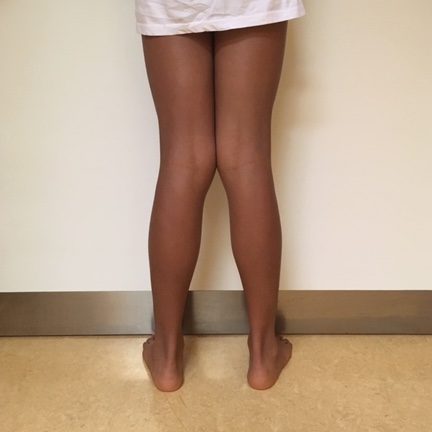
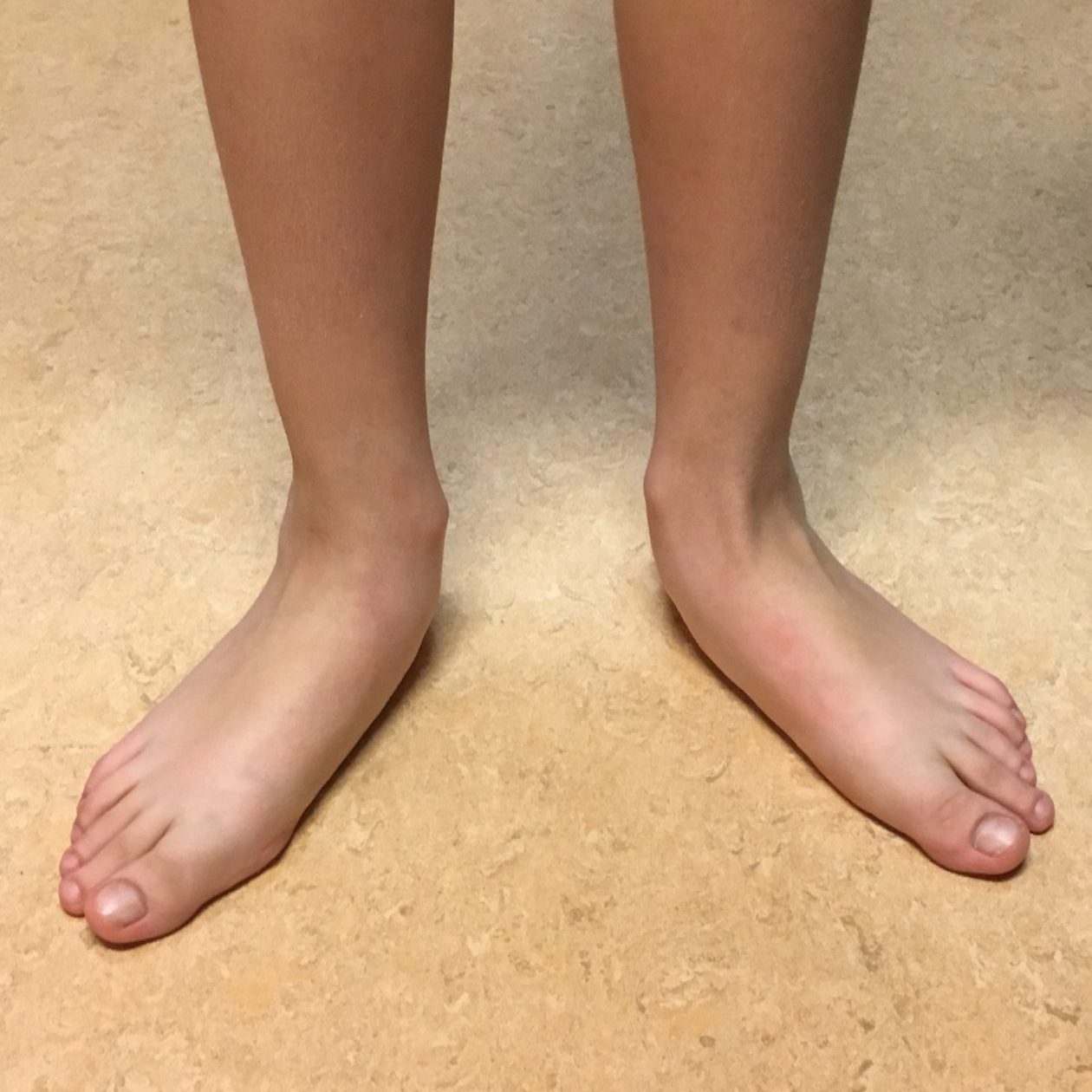
– piede piatto
– deformità del ginocchio in varo e in valgo
– deambulazione sulle punte (toe walker)
– difetti della deambulazione all’interno e all’esterno
– esostosi
– differenze di lunghezza degli arti inferiori (eterometrie)
Dove si trova, contatti utili
La nuova sede, OrtoPediatria Center, si trova all’interno del Polo Pediatrico del Centro Medico Dyadea (in via Larga 8/A a Bologna).
Per avere informazioni o per prenotare contattate il numero di telefono 051 505990 oppure scrivete a prenotazioni@centrimedicidyadea.it
La chirurgia correttiva per la polidattilia del primo dito del piede
La polidattilia preassiale del piede, detto anche alluce bifido o alluce soprannumerario, è una rara malformazione che si caratterizza dalla duplicazione del primo dito del piede.
Questa malformazione congenita viene di solito diagnosticata alla nascita, ed è caratterizzata dalla presenza di una anomalia nel numero delle dita del piede. In particolare, quando si parla di polidattilia preassiale, ci si trova difronte alla presenza di un alluce soprannumerario (all’opposto, nella polidattilia postassiale, il dito soprannumerario è laterale, a livello del quinto dito).
Il dito dito sovrannumerario può avere varia conformazione, può essere costituito da un semplice abbozzo di parti molli, così come da un dito completamente conformato (con relative componenti capsulari, articolari, legamentose ed ossee). Può essere, inoltre, parzialmente o completamente attaccato all’alluce normale.
Un quadro di polidattilia raramente provoca disturbi funzionali, e non incide con l’acquisizione della deambulazione, può tuttavia portare a conflitto con le calzature e disagio estetico.
Come detto, si tratta di una malformazione congenita abbastanza rara, che può essere corretta mediante un intervento chirurgico di asportazione del dito soprannumerario, ed eventuale ricostruzione delle strutture legamentose. La tempistica dell’intervento viene valutata in base all’età del paziente ed alla presenza di eventuali conflitti o disturbi con le calzature.
Oggi pubblichiamo il caso di un paziente di 4 anni, operato dalla dott.ssa Salvatori. Il paziente presentava un alluce bifido era caratterizzato da una fusione cutanea completa tra l’alluce ed il dito sovrannumero.
È stato eseguita la resezione del raggio accessorio e la plastica cutanea. Dopo l’intervento è stato applicata una stecca gessata, ed è stato vietato il carico sull’arto operato per i primi 20 giorni. A guarigione completa delle cicatrici il paziente ha iniziato la graduale mobilizzazione, il carico sul piede operato e l’utilizzo delle normali calzature. Il recupero funzionale è stato ottimale, ed i risultati estetici sono estremamente soddisfacenti.

Intervento di SUPERAnkle
L’intervento di SUPERAnkle è stato ideato dal dr. Paley, ed ha l’obbiettivo di correggere la deformità di piede e caviglia nei pazienti affetta da ipoplasia (detta anche “emimelia”) di perone.
L’ipoplasia peroneale è una rara malformazione congenita, che si caratterizza da deformità del piede associata a ridotta lunghezza della gamba.
Il trattamento moderno di questa patologia non si limita al solo allungamento della gamba più corta, ma parte dalla correzione del piede e della caviglia (e quando necessario del ginocchio). L’obiettivo è di ottenere un appoggio corretto e stabile. Ciò è un requisito indispensabile per il buon risultato della successiva chirurgia di allungamento, e permette di limitare le problematiche correlate all’allungamento stesso (rigidità articolari, deformità secondarie, sublussazioni articolari).
Questo è il caso di un paziente di 3 anni, che è stato sottoposto a intervento di SUPERAnkle, eseguito dalla dr.ssa Bettuzzi.
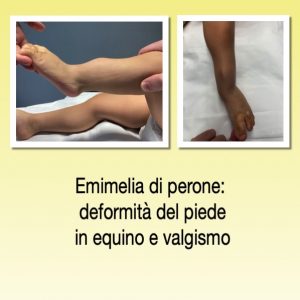
L’intervento prevede una ampia liberazione delle articolazioni malformate. A questa si associa l’osteotomia della tibia, indispensabile al fine di ottenere la completa correzione del piede e della caviglia. L’osteotomia è stata stabilizzata con fili di K, rimossi a circa 40 giorni dalla chirurgia, assieme al gesso.
Al paziente è stato successivamente prescritto un tutore tipo AFO, con rialzo a compensare la differenza di lunghezza, che consente di camminare e di proteggere la correzione ottenuta.
Il risultato clinico è stato estremamente soddisfacente: il piede presenta appoggio completo e la caviglia risulta stabile.
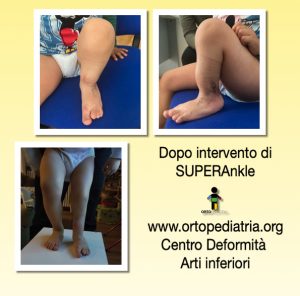
In questo caso, l’intervento di SUPERAnkle rappresenta la prima indispensabile correzione, in previsione della successiva chirurgia di allungamento della gamba.
Per saperne di più sulla diagnosi ed il trattamento dell’ipoplasia di perone visita le pagine dedicate:

Osteotomia femorale nelle PCI
L’osteotomia femorale nei bambini affetti da esiti di PCI è un intervento che, se eseguito con la giusta tempista, può garantire ottimi risultati funzionali.
Infatti, una delle difficoltà maggiori per chi segue i bambini affetti da paralisi cerebrale infantile è comprendere il momento giusto per intervenire su un’anca che si sta progressivamente lussando.
A volte la paura dell’intervento chirurgico comporta un’attesa eccessiva e un progressivo ma severo peggioramento del quadro clinico. Altre volte invece, l’intervento non è adeguato alla problematica presentata (poco efficace o, al contrario, eccessivo). Occorrono esperienza e conoscenze specifiche di Neuro-Ortopedia pediatrica per gestire al meglio queste situazioni.
L’osteotomia femorale è, in realtà, una procedura relativamente semplice per chi si occupa quotidianamente di queste problematiche e può dare ottimi risultati se eseguita con indicazioni e modalità corrette.
L’intervento consiste nella correzione dell’angolazione del collo femorale, che solitamente in questi pazienti è troppo valgo (semplificando, verticale). Tale correzione si esegue mediante una osteotomia del femore, cioè una sezione dell’osso, che viene poi posizionato con una angolazione più corretta e fissato mediante una placca e viti o con una lama-placca (lo strumentario viene scelto in base alle caratteristiche del paziente, ma fondamentalmente ha la funzione di mantenere i capi ossei nella posizione desiderata fino a guarigione dell’osso stesso).
Vi presentiamo il caso di un paziente, con esiti di PCI, operato dalla nostra equipe.
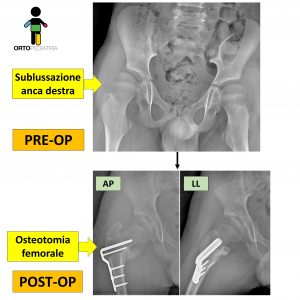
Il paziente presentava una anca destra sublussata, che si stava progressivamente lateralizzando. La chirurgia ha permesso di ripristinare la corretta centratura e copertura della testa femorale.
Questo tipo di chirurgia, se eseguita con le corrette tempistiche, consente di correggere tempestivamente il problema e di evitare il rischio di dover ricorrere a chirurgia più complessa o a volte demolitiva.
È tuttavia fondamentale seguire il paziente nel tempo, ed effettuare i controllo clinici e radiografici necessari che consentono di affrontare il problema nei giusti tempi.
Per saperne di più visita il nostro Centro Specialistico di Neuro-Ortopedia, ed in particolare le pagine dedicate:
– Interventi di ricostruzione per la lussazione dell’anca nelle PCI
– La sorveglianza della lussazione dell’anca nelle PCI

Chirurgia di allungamento dei metatarsi in un caso di brachimetatarsia
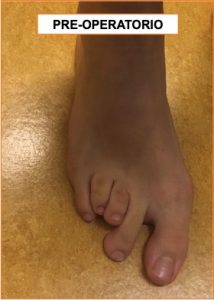
Presentiamo il caso di una ragazzina operata per allungamento dei metatarsi. La paziente presentava un notevole accorciamento del 3 e 4° metatarso del piede destro (detta “brachimetatarsia”), conseguente ad una patologia reumatica che ne aveva danneggiato le cartilagini di crescita, ed interferito con la corretta crescita delle ossa.
La paziente è stata quindi sottoposta ad un intervento chirurgico di allungamento dei metatarsi dall’equipe di OrtoPediatria. La tecnica chirurgica utilizzata ha previsto l’impiego di due piccoli fissatori esterni monoassiali, che hanno consentito il progressivo allungamento delle ossa, fino ad ottenere la correzione desiderata.
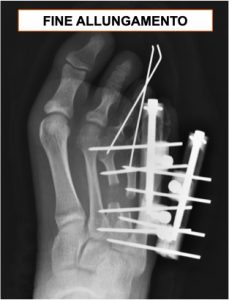
In circa 15 giorni, mediante piccoli allungamenti giornalieri (la famiglia è stata istruita per eseguirli al domicilio), è stata ripristinata la corretta lunghezza dei metatarsi. Sono stati poi necessari alcuni mesi di tempo per consentire la corretta consolidazione del gap osseo generatosi a seguito dell’allungamento. In questa fase la paziente ha potuto deambulare caricando sul retropiede, senza dare il carico sull’avampiede.
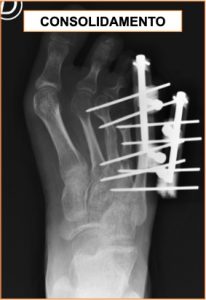
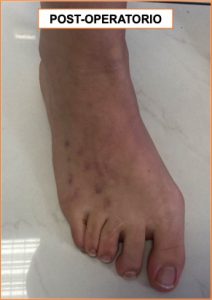
Una volta guarito completamente l’osso, è stato possibile rimuovere i fissatori, con un piccolo intervento chirurgico.
La paziente è stata poi sollecitata alla graduale mobilizzazione del piede e delle dita, alla graduale ripresa della deambulazione con il carico completo su tutta la pianta del piede, al rinforzo muscolare.
Il risultato, dal punto di vista funzionale che estetico, è stato molto soddisfacente.

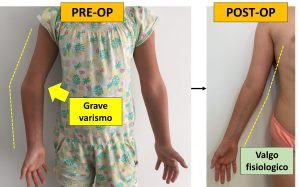
Intervento correttivo per gomito varo postraumatico
Presentiamo il caso di una bambina di 8 anni che è giunta alla nostra attenzione per un gomito varo post-traumatico.
Semplificando, a seguito di una frattura avvenuta al gomito qualche anno prima, l’arto superiore destro non cresceva correttamente. Nel corso della crescita, infatti, il gomito ha mostrato una deviazione in varo (verso l’interno), provocando problemi estetici e funzionali evidenti.
La paziente è stata operata dall’equipe di OrtoPediatria, al fine di ripristinare il corretto asse del gomito (valgismo fisiologico) con un ottimo risultato estetico e funzionale.
In questo caso è stato eseguito un intervento di osteotomia correttiva valgizzante. È stata creata artificialmente una frattura (detta “osteotomia”), ed è stato manualmente corretto l’asse del gomito fino ad ottenere un ripristino della normalità. L’osteotomia è stata poi stabilizzata mediante alcuni fili metallici (detti fili di kirschner), che sono stati rimossi con un secondo piccolo intervento assieme al gesso a distanza di circa 5 settimane dall’operazione.
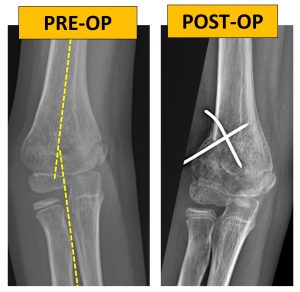
Dopo la rimozione dei fili di kirschner, la paziente è stata avviata alla graduale mobilizzazione del gomito, al fine di recuperare il completo range di movimento in flessione ed estensione. Sono state sconsigliate attività a rischio traumatico per i primi 3 mesi dopo la chirurgia, al fine di evitare possibili lesioni traumatiche a livello dell’osteotomia ancora in corso di guarigione. La paziente è stata invece incentivata a mobilizzare gradualmente e liberamente il gomito ed è stato consigliato il nuoto.
Il recupero è stato molto buono, sia dal punto di vista funzionale che dal punto di vista estetico. A distanza di 6 mesi dall’operazione, la paziente ha ripreso completamente le normali attività di vita quotidiana e sportive. Sono consigliati controlli clinici periodici (annuali) fino a fine della crescita scheletrica della paziente.