Apre il nuovo ambulatorio dedicato alla displasia delle anche
Continua il nostro impegno per la diagnosi precoce ed il trattamento della lussazione e della displasia congenita dell’anca. Inauguriamo un nuovo ambulatorio completamente dedicato alla displasia delle anche.
Ci sarà la possibilità di effettuare:
– ecografie di screening delle anche del neonato (raccomandate in tutti i neonati tra le 4 e le 6 settimane di vita)
– ecografie di secondo livello (per rivalutazione di casi dubbi o per controllo di trattamenti già intrapresi)
– radiografie del bacino, nei casi che lo richiedessero
– trattamenti con divaricatori (applicazione, sistemazione e spiegazioni pratiche)
– confezionamento di gessi
– Valutazione chirurgica dei casi più complessi (riduzione incruenta, cruenta, osteotomie, tettoplastiche, ecc…)
Tutti i passaggi verranno eseguiti da un’equipe dedicata e specializzata. La visita inizierà con l’analisi della storia clinica del piccolo paziente e proseguirà con la visita. Di solito, contestualmente alla visita viene eseguito l’esame ecografico, direttamente in ambulatorio ad opera sempre dei nostri specialisti (con la possibilità di avere un immediato riscontro, e di unire i dati clinici con quelli strumentali ecografici).
Qualora vi fosse riscontro di un quadro di immaturità / displasia / lussazione dell’anca, gli specialisti sapranno darvi tutte le indicazioni ed intraprendere, qualora indicato, immediatamente l’opportuno trattamento.
Nei casi che lo richiedessero (bambini molto grandi, solitamente oltre l’anno di età, o casi dubbi) sarà inoltre possibile eseguire, sempre nella stessa seduta, l’esame radiografico.
L’ambulatorio dedicato alla displasia delle anche si terrà a Bologna presso DYADEA – VIA LARGA.
Per prenotarsi contattare il numero 051505990 (https://www.centrimedicidyadea.it/it/sedi/centro-diagnostico-chirurgico-larga).
Per altre informazioni sulla diagnosi ed il trattamento della displasia delle anche, visita il Centro Specialistico dedicato.

Come applicare di divaricatore di Pavlik per il trattamento della displasia dell’anca?
La displasia dell’anca è una patologia complessa per la quale ancora oggi ci troviamo ad eseguire, nostro malgrado, molti interventi chirurgici. Capita spesso di vedere nei nostri ambulatori piccoli pazienti già in trattamento con varie tipologie di tutore, tra le quali il divaricatore di Pavlik. Evitare alcuni errori di posizionamento ci può spesso aiutare a risolvere il problema.
Innanzi tutto, è bene sempre specificare che la chiave per risolvere il problema non è la chirurgia ma è una diagnosi precoce e un trattamento corretto.
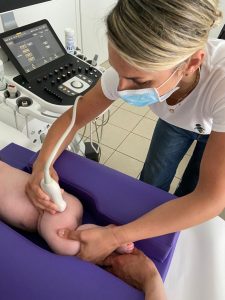
– La diagnosi precoce della displasia dell’anca è basata sull’esame clinico (valutazione della motilità delle anche, di eventuali asimmetrie, del segno di Galeazzi e degli eventuali scatti di Barlow ed Ortolani), da eseguirsi alla nascita ed in occasione dei controlli di salute. L’altro esame imprescindibile per una diagnosi tempestiva è rappresentato dall’ecografia di screening delle anche. Quest’ultimo esame riveste un ruolo fondamentale nell’individuare precocemente ed in maniera affidabile quadri di displasia anche lievi, e va considerato a tutti gli effetti un esame complementare alla visita medica (non sono l’uno sostitutivo dell’altro!!). È molto importante che l’ecografia venga effettuata da personale adeguatamente formato, e le raccomandazioni internazionali consigliano di eseguirla su tutti i neonati, preferibilmente tra la 4^ e la 6^ settimana di vita.
– Per il trattamento corretto della displasia dell’anca possiamo usare diversi tipi di presidi (Milgram, Tubingen, divaricatore di Pavlik …) ognuno di questi ha specifiche indicazioni che ne variano l’utilizzo da caso a caso. Alcuni di questi differiscono di poco l’uno dall’altro, mentre altri trovano campi di applicazione completamente differenti (motivo per cui è importante conoscerli tutti, proprio perché non esiste un divaricatore universale adatto a tutti i tipi di displasia). La cosa più importante è che il centro specializzato sappia utilizzare il divaricatore giusto al momento giusto e sappia applicarlo nel modo corretto.
In questo video spieghiamo come applicare correttamente uno dei presidi universalmente più utilizzati, il divaricatore di Pavlik. Troverete le indicazioni, i consigli utili e gli errori da evitare.
Per saperne di più, visita il Centro Specialistico dedicato alla Displasia dell’Anca

Corso “Ortopedia Pediatrica Oggi”
“Corso teorico pratico – Ortopedia Pediatrica Oggi”
Il corso di settembre è andato talmente bene, e le richieste erano così tante, che siamo stati “costretti” a replicare una seconda data a novembre!!
È una soddisfazione immensa la nostra, non solo per i numeri della partecipazione, ma soprattutto per la qualità. L’apporto dei colleghi pediatri, fisiatri, fisioterapisti, radiologi, osteopati ed ortopedici è stato davvero prezioso per la buona riuscita del nostro Corso di Ortopedia Pediatrica.
Siamo felici di annunciare nuove edizioni, che non si terranno solamente a Bologna, ma anche in altre sedi. A breve comunicheremo date e luoghi. Come da sempre dichiarato, anche nel nostro motto, la formazione riveste per noi un ruolo molto importante … oseremmo dire vitale!
Questo nostro corso è dedicato alla principali problematiche dell’ortopedia pediatrica. Partendo dal neonato (affrontando le tematiche delle malformazioni congenite del piede e della displasia dell’anca – diagnosi e screening ecografico a cui dedicheremo un momento particolare per favorire la comprensione delle immagini ecografiche), si prosegue poi con il bambino e l’adolescente (in particolare analizzando alcune delle problematiche più comuni, quali le deviazioni assiali delle ginocchia – ginocchio varo e valgo, i difetti della deambulazione in intra ed extra-rotazione, la scoliosi, le eterometrie degli arti inferiori). Si parlerà anche di problematiche ortopediche in pazienti con patologie neurologiche e di profilassi antitromboembolica in età pediatrica.
Corso patrocinato SIP (Società Italiana Pediatria) che da diritto a 8,8 crediti ECM.
Il corso è riservato a un numero limitato di partecipanti
- Prima edizione: Sabato 24/9/2022 a Bologna
- Seconda edizione: Sabato 26/11/2022 a Bologna
La pseaudartrosi congenita di gamba
La pseudartrosi congenita di gamba è tra le patologie più difficili da trattare in ortopedia pediatrica. Gli interventi eseguiti tradizionalmente hanno limitate possibilità di successo al fine di ottenere la guarigione, e diverse famiglie si trovano spesso costrette a recarsi all’estero per cercare una valida soluzione.
Vi mostriamo il caso di una bimba di 3 anni che presentava una grave malformazione congenita della gamba: tibia e perone erano “congenitamente fratturate” e non guarivano (quadro clinico chiamato appunto “pseudartrosi congenita”). Le ossa erano sempre più deformate ed accorciate, e la gestione con tutori appositi confezionati su misura non era sufficiente a limitare il progressivo peggioramento della deformità.
Abbiamo sottoposto la bimba a un intervento chirurgico di ricostruzione ossea complesso e delicato, secondo la metodica più moderna descritta dal dr. Dror Paley (uno dei principali esperti mondiali nel trattamento di questa problematica), ottenendo la consolidazione della zona patologica di pseudartrosi.
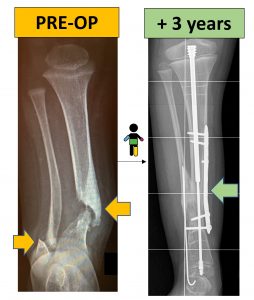
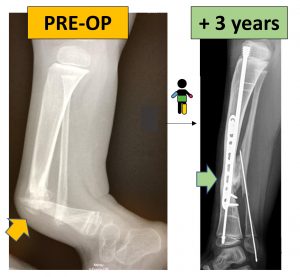
A distanza di anni, la consolidazione si mantiene regolarmente e la funzionalità è ottima. La situazione richiederà ancora ulteriori procedure con la crescita, ma il risultato è pienamente soddisfacente. L’arto mantiene un corretto asse, e la bambina cammina con la semplice protezione di un tutore.
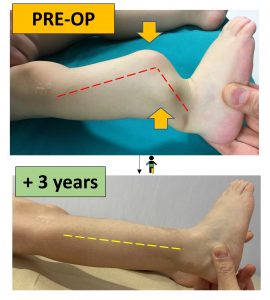
La pseudartrosi congenita della gamba è indubbiamente una problematica molto rara e piuttosto complessa da trattare, ma se affrontata correttamente fin dall’inizio è possibile ottenere dei buoni risultati.
È importante, per questa condizione, rivolgersi a centri con esperienza specifica ed affidarsi a medici con esperienza in queste tecniche più complesse, ma tuttavia affidabili.
Per saperne di più, visita il Centro Specialistico delle Deformità Congenite degli Arti Inferiori, lì troverai anche una scheda approfondita dedicata alla Pseudartrosi Congenita della Tibia.

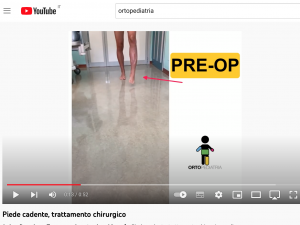
Intervento correttivo per piede cadente
Questo ragazzo di 14 anni si è presentato alla nostra attenzione per una paralisi dei muscoli della gamba provocata da un grave trauma.
Era presente un danno funzionale severo (“piede cadente” e cammino con steppage) e il ragazzo era costretto ad avvalersi di un tutore per camminare.
Dopo l’intervento chirurgico eseguito da M.Lampasi, C.Bettuzzi, G.Salvatori e G.Lucchesi dell’equipe OrtoPediatria, il cammino è divenuto più fisiologico ed è stato possibile abbandonare il tutore.
Per saperne di più, visita il centro specialistico di Neuro-Ortopedia

Il piede talo valgo pronato
Il piede talo valgo pronato è una deformità del piede di frequente riscontro alla nascita.
Di cosa si tratta?
Il piede talo valgo pronato è un piede rivolto verso l’alto in modo eccessivo, che fa resistenza se si cerca di rivolgerlo verso il basso, con tensione dei muscoli estensori. Guardandolo da sotto invece , il retropiede (la parte posteriore del piede) è rivolto eccessivamente verso l’esterno (valgo!) e resiste alle manovre di correzione.
Come riconoscere il piede tale valgo pronato, trattarlo?
Quali manovre, quando e per quanto tempo eseguirle?
Ecco un nuovo video di OrtoPediatria che vi aiuterà a fare chiarezza!

Alterazioni ungueali nel piede torto
Le alterazioni ungueali nei bimbi affetti da piede torto congenito rappresentano fonte di preoccupazione da parte dei genitori. Spesso ci viene chiesto il motivo di tale alterazione.
Ecco una recente pubblicazione scientifica, nata da una collaborazione multispecialistica tra ortopedici e dermatologi, e che ha visto coinvolti i medici di OrtoPediatria.

Ma questa ecografia delle anche è fatta bene???
L’ecografia delle anche va eseguita a tutti:entro la prima settimana se è presente lo scatto di Ortolani, tra le 4 e le 6 settimane di vita in tutti gli altri casi.
Queste sono le raccomandazioni delle Società Italiane di Pediatria, Ortopedia Pediatrica e Radiologia Medica del 2020.
Tuttavia, non è sufficiente eseguire un’ecografia, è fondamentale che questa venga eseguita seguendo scrupolosamente le regole! E purtroppo ci accorgiamo che non sempre è così…
Allo scopo di migliorare la consapevolezza degli operatori sanitari, e di fornire lo uno strumento utile per orientarsi nella lettura delle ecografie delle anche del neonato, si è tenuto questa settimana il 2^ Live-Webinar di OrtoPediatria.
Il titolo? “Ma questa ecografia delle anche è fatta bene? Verifichiamolo insieme”.
A seguire è uscita anche la scheda dedicata, da seguire passo passo per iniziare a comprendere gli aspetti fondamentali delle ecografie delle anche.

Una settimana dedicata alla Neuro-Ortopedia Pediatrica
Le attività di OrtoPediatria di questa settimana sono state interamente dedicate alla Neuro-Ortopedia Pediatrica!!
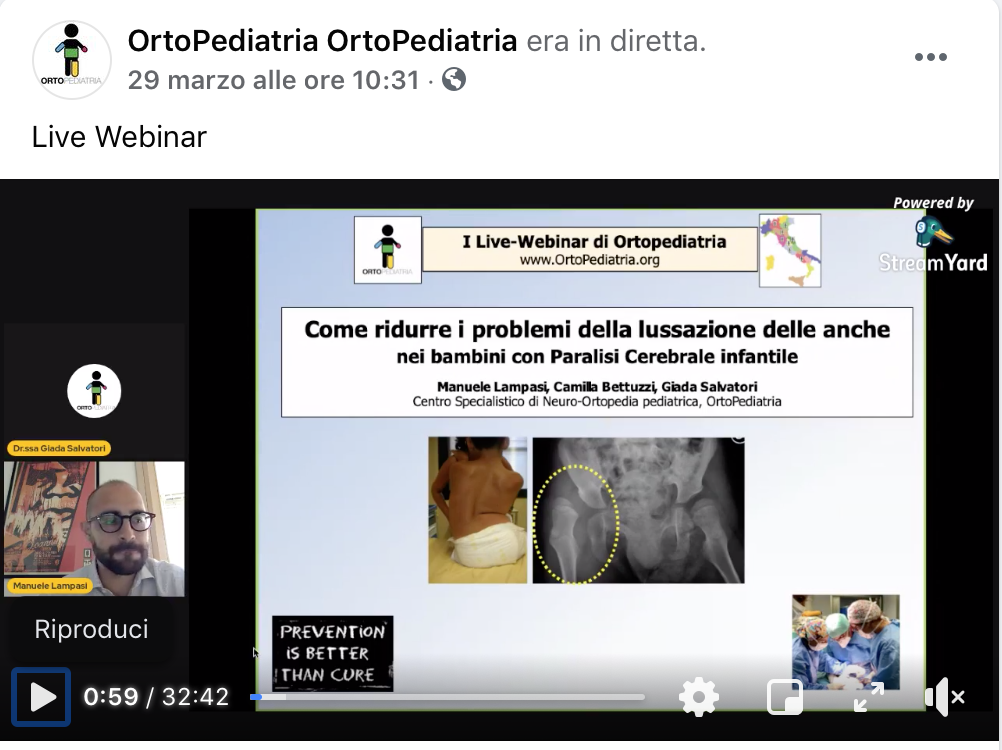
Lunedì, infatti, si è tenuto il primo Live-Webinar di OrtoPediatria: “Come ridurre i problemi della lussazione delle anche nei bambini con Paralisi Cerebrale Infantile”. Un argomento che sta molto a cuore a tutti noi, e verso il quale vogliamo sensibilizzare genitori, caregivers, fisioterapisti e tutti gli altri operatori sanitari.
Se ve lo siete perso, potete rivederlo alla pagina FaceBook di OrtoPediatria:
Inoltre, esce oggi un nuovo video sulle potenzialità della Chirurgia Funzionale Multi-Level nelle PCI:
In questo video un caso di un paziente adolescente, con grave quadro di deambulazione in flessione (Crouch) bilaterale che ne avrebbe gradualmente compromesso totalmente le capacità deambulatorie. Sottoposto a chirurgia multi-level prima ad un lato, e dopo poche settimane all’altro arto. Dopo la chirurgia trattato con fisioterapia e rieducazione funzionale intensiva precoce, con risultati funzionali sorprendenti e stabili a distanza di anni.

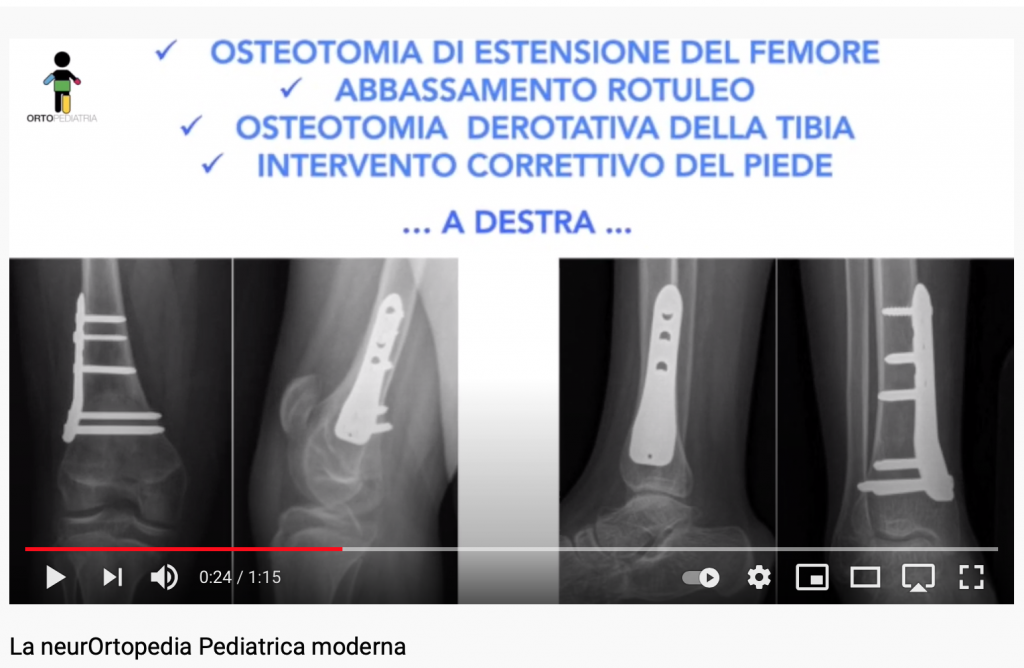
Le sfide dell’ortopedia pediatrica moderna
L’ortopedia pediatrica è solo piede piatto e plantari. Anche questo campo, assieme al resto della medicina, ha potuto sfruttare le evoluzioni e i nuovi strumenti che la tecnologia oggi mette a disposizione.
L’ortopedia pediatrica moderna è in grado di affrontare sfide impervie ed i casi più complicati, offrendo soluzioni incredibili.
Nel video, il caso di un bambino di 10 anni, affetto da una patologia ossea che ne aveva deformato gravemente gli arti inferiori. Dopo due complessi interventi chirurgici, e grazie all’impianto di fissatori esterni esapodalici, è stato possibile correggere gradualmente le deformità, fino ad ottenere il completo e corretto allineamento di entrambi gli arti inferiori.